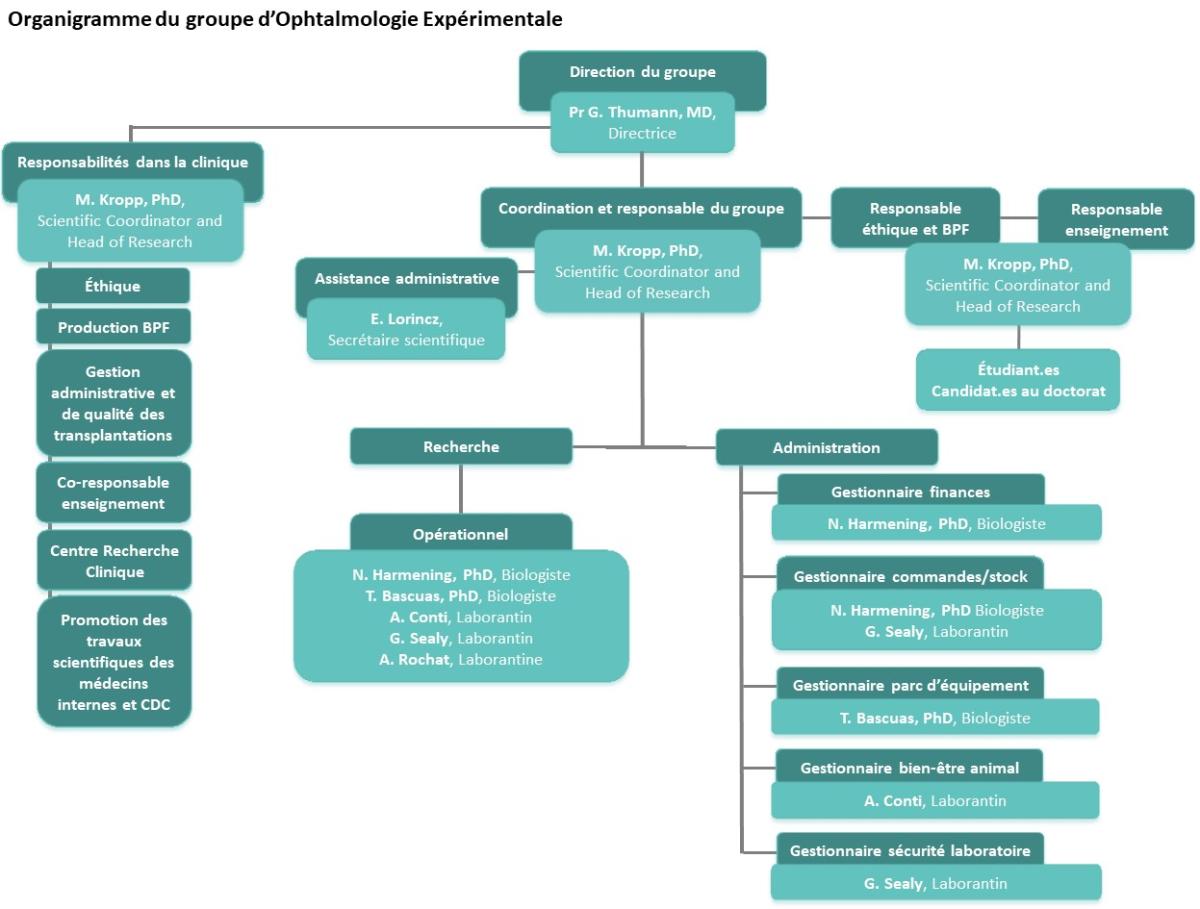
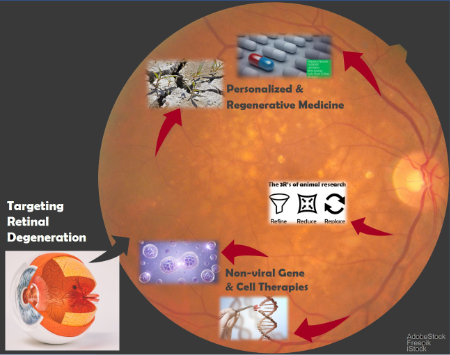
Le groupe d’ophtalmologie expérimentale est un centre de recherche et d’enseignement orienté sur l’optimisation des traitements des maladies rétiniennes, telles que la dégénérescence maculaire liée à l’âge (DMLA) et la rétinopathie diabétique. Nous nous concentrons sur la médecine personnalisée et régénérative. Nous travaillons sur le développement de médicaments de thérapie innovante (MTI, soit ATMP pour Advanced Therapeutic Medicinal Products) basés sur des produits cellulaires respectant les normes de bonnes pratiques de fabrication (BPF, soit GMP pour Good Manufacturing Practice) pour traiter les maladies neurodégénératives de l’œil. Pour concevoir cette médecine personnalisée, nous utilisons des modalités de thérapies régénératives, géniques et cellulaires, telles que la transplantation de cellules génétiquement modifiées et de cellules souches pluripotentes induites. Nous travaillons également à la réduction de l’expérimentation animale (« 3R » : Raffiner, Réduire, Remplacer), notamment par la culture de rétine et la culture de cellules sans produits animaux. Finalement nous testons de nouveaux biomatériaux et des systèmes d’administration de médicaments innovants.
À l’heure actuelle, nos recherches s’articulent autour des projets suivants :
Thérapie cellulaire génique basée sur les transposons pour le traitement de maladies neurodégénératives rétiniennes
Dans le projet TargetAMD (www.targetamd.eu), nous avons développé une thérapie cellulaire génique personnalisée pour la DMLA néovasculaire (dite « humide »). Le projet, coordonné par la Pre G. Thumann, a été financé par le « 7ème programme-cadre pour la recherche et le développement technologique » de l’Union Européenne (no. 305134) et il est poursuivi grâce à une bourse de la fondation ProVisu. Cette thérapie vise à inhiber la croissance vasculaire aberrante et à permettre la régénération de l’architecture rétinienne. Ce projet a compris de multiples étapes de développements et de validations in vitro et in vivo. Après validation de la production de cellules pigmentées iriennes (EPI) génétiquement modifiées de norme BPF, nous avons obtenu l’approbation de la Commission Cantonale d’Éthique de la Recherche (CCER) pour réaliser l’étude clinique de phase Ib/IIa. Nous sommes maintenant dans l’attente de l’accord des autorités suisses. Lors de la production, les cellules EPI isolées depuis une biopsie irienne sont modifiées génétiquement par l’addition du gène dans le génome cellulaire du facteur dérivé de l’épithélium pigmentaire (PEDF pour Pigment Epithelium Derived Factor). Pour ce faire, nous utilisons le système de transposon Sleeping Beauty. Ces procédures sont réalisées dans une structure dédiée satisfaisant aux normes BPF. Puis ces cellules sont transplantées dans l’espace sous-rétinien du même patient, le tout lors d’un unique acte chirurgical.
Dans la DMLA atrophique (dite « sèche ») et contrairement à la DMLA néovasculaire, la perte des cellules de l’épithélium pigmentaire rétinien (EPR) n’est pas associée à la croissance de nouveaux vaisseaux, mais résulte probablement de réactions inflammatoires et du stress oxydatif. En partant de l’approche non virale établie pour le projet TargetAMD, nous utilisons une transplantation de cellules modifiées génétiquement qui permet l’apport continu de facteurs neuroprotecteurs à la rétine pour prévenir la perte et la dégénérescence de l'EPR. En collaboration avec le Pr L. Scapozza, UNIGE, nous testons si la transplantation in vivo de cellules de l'EPR génétiquement modifiées pour exprimer les gènes codant pour les protéines neuroprotectrices PEDF et GM-CSF (granulocyte macrophage-colony forming factor), prévient effectivement la perte des cellules de l'EPR. Nous espérons que ces cellules rétabliront un environnement neuroprotecteur et inhiberont la progression de la dégénérescence. La récupération de la vision est analysée par des méthodes fonctionnelles, comportementales, cellulaires et moléculaires. Après les études de validation de ce concept in vitro, nous espérons démontrer, en collaboration avec le Pr Z. Ivics, Paul-Ehrlich Institute, la sécurité de ce traitement. Ce projet est financé par le Fond National Suisse (Financements : FNS, no. 160195 et no. 189341).
Thérapie génique non virale basée sur les cellules souches pour traiter la DMLA sèche avancée. Cependant, l'approche précédente ne convient qu'aux patients à un stade précoce de la maladie, puisque les cellules détériorées ne sont pas remplacées. Des thérapies utilisant des cellules souches sont actuellement à l’étude, qui permettraient de répondre à cette nécessité médicale. Notre hypothèse est que les cellules transplantées dans une rétine endommagée et dans un environnement « toxique » ne peuvent pas survivre de manière permanente. Ainsi nous proposons de combiner l'approche basée sur les cellules souches, avec notre thérapie génique, pour offrir une solution permanente aux patients souffrant de DMLA sèche à un stade avancé. Nous proposons de modifier génétiquement des cellules souches pluripotentes induites (iPS), de les différencier en cellules EPR et de tester dans des cultures cellulaires et rétiniennes l'innocuité et l'efficacité de ce nouveau médicament cellulaire destiné à traiter la DMLA sèche à un stade avancé. (Financement : Fondation Haas).
Culture organotypique rétinienne en tant que modèle ex vivo satisfaisant aux principes des « 3R » pour tester de nouveaux médicaments et thérapies. Dans ces projets, nous ne cultivons pas seulement des cellules mais un organe complet – la rétine. Nous induisons également des conditions pathogéniques (p. ex. l’induction de stress oxydatif) pour développer un modèle ex vivo de neurodégénérescence rétinienne, comme la DMLA atrophique. Par exemple, la capacité neuroprotectrice de deux protéines multifonctionnelles (PEDF et GM-CSF) surexprimées dans des cellules transfectées sera évaluée par des analyses biochimiques et immuno-histologiques. (Financements : projet FNS no. 189341; Prix Dr. Gaide et Böringer Ingelheim).
Électroporation oculaire in vivo pour traiter la neurodégénérescence rétinienne. Dans ce projet, nous développons une nouvelle méthode de transfection (c.-à-d. l’introduction d’une séquence d’ADN dans le génome hôte) en utilisant l’électroporation (technique qui permet d’augmenter la perméabilité membranaire en appliquant un champ électrique) in vivo pour cibler l'EPR. Notre objectif est de simplifier le traitement pour le patient et d’augmenter la sécurité de la thérapie. Nous utilisons actuellement un modèle d’yeux ayant une taille similaire aux yeux humains. Nous prévoyons ensuite d’investiguer un promoteur (séquence d’ADN qui permet l’expression d’un gène) spécifique de l'EPR pour augmenter le profil de sécurité. Ce projet est mené en collaboration avec le Pre Z. Izsvák, Max-Delbrück Center for molecular Mededin in the Helmholtz association. (A été financé par : Fondations Schmieder-Bohrisch et AURIS).
Spécificité des profiles moléculaires du liquide lacrymal (larmes) chez les patients diabétiques avec ou sans rétinopathie ‑ Prototype d’outil diagnostique des sous-types d’atteinte. « Subtype-specific molecular patterns in tear fluid of diabetic patients with and without retinopathy – predictive tool prototype ». La rétinopathie diabétique proliférante active (RDPA) représente la première cause de cécité dans la population en âge de travailler. Ce projet vise à développer un outil diagnostique permettant de détecter les patients diabétiques prédisposés à déclencher cette forme sévère, de ceux susceptibles de ne développer qu’une forme modérée ou aucune rétinopathie. L’idée sous-jacente est de rechercher les biomarqueurs représentatifs de cette pathologie chronique et sévère dans le film lacrymal, que l’on peut facilement collecter de manière non-invasive. Un diagnostic plus rapide et plus aisé permettrait ainsi de prendre en charge les patients prédisposés à la RDPA plus tôt, afin d’éviter une perte sévère de la vision. (Financement : Fondation privée LHW).
Culture non-xénogénique de cellules oculaires par utilisation de lysat plaquettaire humain pour développer des thérapies personnalisées. Les médicaments de thérapies innovantes, y compris les thérapies régénératives, génétiques et cellulaires, demandent des conditions spécifiques de production et de contrôle qualité. Une de ces conditions recommande l’utilisation de matériel non xénogénique (c.-à-d. ne provenant pas d’autres espèces) pour effectuer les cultures cellulaires, de manière à augmenter la sûreté du produit ; par ailleurs l’utilisation d’alternatives au sérum de veau fœtal est plus éthique. Dans ce projet, nous développons un système de culture non-xénogénique de cellules oculaires, par utilisation de lysats de plaquettes humaines issues de dons de sang. Ce système de culture cellulaire permet de satisfaire d’une part, le principe des « 3R » pour l’expérimentation animale et d’autre part, les exigences de qualité de nos produits cellulaires. En outre, l’utilisation de lysat plaquettaire autologue (c.-à-d. provenant du patient lui-même) améliorera la sécurité du produit pour le patient. (Financement : ARVO EyeFind Research grant).
Analyse des facteurs génétiques dans la pathogenèse du glaucome et analyse des effets thérapeutiques et des mécanismes d'action des inhibiteurs de canaux KATP. Nous avons découvert que la régulation des canaux potassiques ATP-dépendant (KATP) peut entrainer une diminution de la pression intra-oculaire (PIO) et affecte la dynamique de la production aqueuse. Nous avons postulé qu’une mutation de gènes codant pour les canaux KATP pourrait être responsable de l’augmentation de la PIO observée dans le glaucome. En effet, dans une étude pilote, nous avons trouvé 3 polymorphismes de nucléotide simple (SNPs) de la lignée germinale dans l'ADN de patients atteints de glaucome, qui pourraient être impliqués dans l'augmentation de la PIO et la neurodégénérescence rétinienne. Dans ce projet, nous envisageons de collecter des échantillons de salive d'une grande cohorte de patients atteints de glaucome, afin d'analyser les mutations génétiques impliquées dans l'ouverture des canaux KATP et dans la pathogenèse du glaucome. Une étude chez le lapin examine les effets des inhibiteurs des canaux KATP sur la réduction de la PIO, sur l'augmentation du débit de l'humeur aqueuse et sur la protection des cellules ganglionnaires de la rétine. (Financement : Fonds Castier, HUG).
Nos autres centres d’intérêt en recherche incluent l’amélioration du contrôle qualité des médicaments de thérapies innovantes lors de leur processus de fabrication, en utilisant la spectroscopie Raman (permet une caractérisation propre à chaque cellule comme l’est l’empreinte digitale à chaque humain), l’analyse de l’activité neuroprotectrice de la scutellarine et de la toxicité de la décaline sur la neurorétine, ainsi que l’évaluation du rôle de la lysyl oxydase dans la rétinopathie diabétique. En collaboration avec le Pr D. Ghezzi, EPFL, nous avons également établi un modèle in vivo pour l’implantation d’électrodes intra-neurales à ouverture autonome. Ces électrodes permettent de stimuler le nerf optique et d’enregistrer son activité électrophysiologique, afin de restaurer la vision par des prothèses de nerf optique. Notre collaboration avec le Pr T. Wolfensberger, le Pr M. Thiel et le Pr Bignens vise à promouvoir le développement de la médecine personnalisée, grâce au Swiss Ophthalmic Imaging Network (« SOIN »), un système national sécurisé de données ophtalmologiques et de diagnostic des patients. (Financement : SPHN - Swiss Personalized Health Network).
Les données publiées sont disponibles pour consultation sur les repositories Yareta et Zenodo :