Généralité
Après la découverte de l'insuline par Banting et Best en 1922, le diabète a cessé d'être une maladie rapidement fatale. Des complications chroniques sont apparues, essentiellement en raison de l'inaptitude du traitement insulinique à régler finement les glycémies. Seule une insulinothérapie intensive peut réduire ces atteintes ; mais ce type de traitement est associé à une nette augmentation du nombre d'épisodes hypoglycémiques .
La transplantation de pancréas permet l'arrêt du traitement d'insuline tout en rétablissant des valeurs glycémiques normales. A 1 et 3 ans, 80% des greffons sont fonctionnels. Cette greffe constitue pourtant toujours une intervention lourde avec une morbidité significative .
La transplantation d'îlots est une alternative très attractive en raison de sa simplicité, de sa faible morbidité et de résultats en amélioration. Les derniers chiffres du Registre International de transplantation d'îlots dénombrent 267 allogreffes chez des patients diabétiques de type I entre 1990 et décembre 1998 en progression par rapport à 90 entre 1974 et 1989 . Les résultats démontrent une fonction des îlots (C-peptide >= 0.5 ng/ml ou >= 0.16 m mol/l) chez 68% des receveurs. Ces greffes permettent une amélioration de l'hémoglobine glyquée et une diminution du nombre d'hypoglycémies. Le taux d'insulino-indépendance à un an rapporté dans le Registre International est de 8% .
Le protocole d'allotransplantation d'îlots du groupe d'Edmonton (Canada) publié le 27 juillet 2000 dans le New England Journal of Medicine démontre une fonction plus élevée que celle rencontrée jusqu'ici . Le taux d'insulino-indépendance à un an passe de 8% à 100% ! Ces chiffres sont comparables à ceux de la transplantation de pancréas entier.
De tels résultats suscitent bien entendu d'importants espoirs. Ils permettraient d'élargir, s'ils étaient confirmés, les indications à la greffe d'îlots. Nous proposons une revue de notre expérience et un explicatif des résultats canadiens. Nous redéfinissons également les indications à la transplantation chez le patient diabétique.
Expérience genevoise en allotransplantation d'îlots de Langerhans humains
Le centre de Genève se situe dans les cinq premiers centres mondiaux en terme de nombres et de résultats de transplantations d'îlots. Il est au centre de Gragil (Groupe Rhin, Rhône-Alpes et Genève pour la transplantation d'Ilots de Langerhans), qui regroupe les hôpitaux universitaires de Besançon, Grenoble, Lyon et Strasbourg. Ce groupement a été créé en 1999 afin d'augmenter le nombre de donneurs et de faire bénéficier au plus grand nombre de patients d'un traitement par greffe d'îlots. Les pancréas prélevés dans les hôpitaux voisins sont amenés au laboratoire de Genève, où l'isolement est effectué. La transplantation est ensuite réalisée dans chaque centre et chez le patient qui présente la meilleure compatibilité immunologique.
De 1994 à octobre 2000, 26 allotransplantations ont été réalisées à Genève et dans les centres français membres de Gragil. Parmi les 19 patients greffés à Genève, douze ont bénéficié d'une greffe d'îlots et de rein simultanée, six d'une greffe d'îlots après rein et un d'une greffe simultanée îlots-poumon. Tous les patients ont présenté une reprise de fonction du greffon après injection, attestée, à trois mois, par un taux normal de C-peptide (100% vs. 68% dans le Registre International). A une année, 10/16 patients présentent toujours des îlots fonctionnels (62% vs 35% dans le Registre International). L'hémoglobine glyquée est respectivement de 8.7% et 5.6%, avant et trois mois après la greffe. Trois patients sont devenus insulino-indépendants (3/19, 16% vs 10% dans le Registre International). La plus longue insulino-indépendance est actuellement de plus de 4 ans. Toutes ces transplantations ont été réalisées avec un protocole immunosuppresseur comprenant de la ciclosporine (Sandimmun Néoral, Novartis, Bâle), du mycophénolate mophetil (CellCept, Roche, Bâle) et des corticostéroïdes.
Ces résultats démontrent qu'une technique d'isolement d'îlots adéquate permet d'obtenir une fonction primaire du greffon chez tous les patients. Ceci représente une progrès majeur par rapport au résultats du Registre International. Néanmoins, le protocole immunosuppresseur utilisé jusqu'à ce jour, n'a pas permis de prévenir le rejet ou la récidive de la maladie diabétique chez certains patients. De plus, l'utilisation de corticostéroïdes induit une forte résistance à l'insuline. Ces facteurs sont particulièrement délétères et expliquent le faible taux d'insulino-indépendance sous ce régime immunosuppresseur.
Le protocole d'Edmonton
L'équipe d'Edmonton a rapporté des transplantations d'îlots chez 12 patients consécutifs diabétiques de type I non-urémiques (J. Shapiro et al, Congrès mondial de la Société de Transplantation, Rome, août 2000). Un suivi moyen de 15 mois démontre une insulino-indépendance chez tous les patients avec une tolérance au glucose quasi-normale. L'hémoglobine glyquée moyenne et respectivement de 8.9% et 5.5% avant et 12 mois après greffe. Le C-peptide, négatif chez tous les patients avant la greffe, est de 0.6 m mol/l sans stimulation et de 1.8 m mol/l après un repas standard, six mois après greffe. Ces résultats sont similaires à ceux de transplantations pancréatiques, avec cependant une morbidité moins élevée.
Les originalités de cette étude résident en trois points principaux :
Le régime immunosuppresseur se compose d'une induction par des anticorps anti-récepteurs d'interleukine 2 (Daclizumab, Zenapax®, Roche) et d'un traitement de maintenance comprenant le sirolimus (Rapamune®, Wyeth Ayers) et le tacrolimus (Prograf®, Fujisawa). Ce traitement, mis sur pied grâce à la disponibilité récente du sirolimus, a pour particularité l'absence de corticostéroïde et des taux très faibles de tacrolimus, ce qui permet de limiter les effets diabétogènes.
Plusieurs injections d'îlots provenant de 2 à 4 donneurs sont réalisées chez chaque patient, jusqu'à ce que celui-ci devienne insulino-indépendant. Ces greffes sont effectuées immédiatement après l'isolement. Ce procédé permet d'une part d'augmenter le nombre d'îlots (11500 îlots-équivalents/Kg de poids corporel) et d'autre part d'éviter la mise en culture. Une nouvelle hospitalisation de 1 à 14 jours (moyenne : 3 jours) est nécessaire à chaque injection.
Les patients ne présentent pas de néphropathie diabétique et reçoivent les îlots en l'absence d'une autre greffe. Ceci n'avait que rarement été pratiqué jusque là.
Cette étude est très encourageante et constitue un progrès majeur dans le domaine de la transplantation d'îlots. Des organismes américains publique (National Institutes of Health) et privé (Juvenile Diabetes Foundation International) ont mis sur pied une étude multicentrique visant à confirmer et à améliorer ces résultats. Un objectif supplémentaire est de réduire le nombre de pancréas utilisés. Dix centres (sept américains et trois européens, dont Genève) ont été sélectionnés sur le base de leur expérience dans le domaine. Ils vont tenter de reproduire ces résultats au niveau mondial dans le cadre d'un même protocole.
A quel patient diabétique faut-il proposer une transplantation ?
La transplantation d'îlots de Langerhans est réservée à des patients atteints de diabète de type I. Le diabète de type II présente en effet des mécanismes physiopathologiques, avec entre autre une importante résistance périphérique, qui rendent un traitement par injection d'îlots inadéquat.
Les patients diabétiques de type I avec un diabète instable, des hypoglycémies fréquentes et mal ressenties présentent la meilleure indication à une transplantation d'îlots. Il faut également relever que le nombre d'îlots requis pour permettre une bonne régulation glycémique est proportionnel au poids du patient. Les receveurs avec un faible poids corporel ont ainsi plus de chance de devenir insulino-indépendants .
La greffes d'îlots peut être effectuée après ou en même temps qu'une autre greffe afin de tirer profit de l'immunosuppression justifiée par l'autre organe. Une injection d'îlots peut être ainsi proposée à des patients déjà porteurs d'un organe, en général un rein (néphropathie diabétique) ou plus rarement un poumon (mucoviscidose avec absence de sécrétion d'insuline endogène). Chez ces patients, nous envisageons une transplantation d'îlots plutôt que celle de pancréas entier.
Une transplantation conjointe (le plus souvent rein/pancréas et rein /îlots) doit être proposée à tous les patients diabétiques en attente d'un organe. La qualité de vie et la survie elle-même sont significativement améliorées après une transplantation combinée rein/pancréas en comparaison avec celle d'un rein seul . Les complications du diabète, entre autre la neuropathie et la néphropathie, sont améliorées ou freinées . Les patients porteurs de peu de séquelles de leur diabète et à faible risque opératoire, doivent en premier lieu se voir offrir une greffe combinée rein-pancréas. Celle-ci permet d'obtenir une excellente régulation glycémique, avec 80% de pancréas fonctionnels à 3 ans . Certains patients à risque opératoire trop important ou qui ne désirent pas une greffe de pancréas doivent pouvoir bénéficier d'une transplantation combinée rein-îlots de Langerhans.
Les résultats récents obtenus par l'équipe d'Edmonton (100% d'insulino-indépendance chez 12 patients consécutifs avec un suivi moyen de 15 mois) permettent de justifier une immunosuppression pour une transplantation d'îlots seuls. Ce protocole repris dans l'étude multicentrique, s'adresse à des patients diabétiques de type I sélectionnés selon des critères stricts.
Quels sont les risques d'une transplantation d'îlots?
La morbidité d'une transplantation d'îlots est faible. Il faut distinguer deux types de risques: ceux liés à l'injection elle-même et ceux liés aux médicaments immunosuppresseurs.
Les complications potentielles de l'injection sont de type hémorragique ou thrombotique. Sur les 42 patients greffés à Genève et dans Gragil (allo- et auto-greffes), on dénombre une thrombose partielle d'une branche portale réversible sous anti-coagulants, un hémopéritoine et deux hématomes sous-capsulaires après ponction per-cutanée, trans-hépatique. Dans la série d'Edmonton, on relève deux hématomes hépatiques sous-capsulaires sur 26 injections chez 12 patients.
Le régime immunosuppresseur le plus récent est composé de sirolimus et de tacrolimus. La combinaison de deux de ces substances permet de réduire le dosage du tacrolimus et ainsi de diminuer ses effets secondaires diabétogène et néphrotoxique. En évitant tout corticostéroïde, l'hyperlipidémie et l'hypercholestérolémie attendues avec le sirolimus n'ont pas été retrouvées dans l'étude canadienne . Les risques potentiels à long terme de l'immunosuppression sont principalement de nature infectieuse et oncologique. Pour ce nouveau protocole, des résultats à long terme ne sont pas encore disponibles. Néanmoins, l'expérience préliminaire avec l'utilisation de ces médicaments dans la transplantation rénale, avec des doses plus importantes et en utilisant des stéroïdes, montre que les risques infectieux et oncologique sont probablement comparables à ceux d'une immunosuppression conventionnelle avec de la ciclosporine.
Comment les îlots de Langerhans sont-ils isolés du pancréas ?
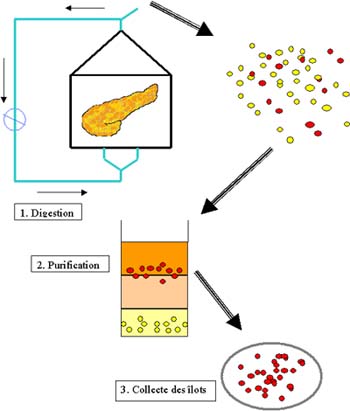 Lors d'allotransplantation, les îlots sont isolés à partir de pancréas de donneurs multi-organes en mort cérébrale. Le pancréas est prélevé dans le délai le plus bref, puis acheminé au plus vite dans le laboratoire. L'isolement débute par la dissection du pancréas, puis par l'injection d'une enzyme, la collagénase (Liberase®, Roche, Bâle) dans le canal de Wirsung.
Lors d'allotransplantation, les îlots sont isolés à partir de pancréas de donneurs multi-organes en mort cérébrale. Le pancréas est prélevé dans le délai le plus bref, puis acheminé au plus vite dans le laboratoire. L'isolement débute par la dissection du pancréas, puis par l'injection d'une enzyme, la collagénase (Liberase®, Roche, Bâle) dans le canal de Wirsung.
L'organe est placé dans une chambre de digestion, où la dissociation s'effectue à 37°. Afin d'évaluer l'état de digestion, des échantillons sont prélevés et l'arrêt est effectué lorsque les îlots sont libérés, mais avant que ceux-ci ne soient abîmés par une digestion trop prolongée. L'arrêt se fait par dilution de la collagénase et par diminution de la température à 4° (température à laquelle la collagénase est la moins active).
La deuxième phase de l'isolement consiste à purifier les îlots du parenchyme exocrine digéré au moyen d'un gradient de densité. Les îlots ont en effet une densité plus faible que le tissu exocrine. Au terme de l'isolement, les îlots peuvent être mis en culture avant la transplantation ou directement injectés. Un tel isolement dure de 5 à 6 heures.
Comment une transplantation d'îlots est-elle réalisée ?
Le site retenu pour la greffe d'îlots est le foie. Il a une double vascularisation et représente le principal organe cible pour l'insuline. Les îlots sont embolisés dans les veinules pré-sinusoïdales via la veine porte. Deux méthodes sont utilisées pour l'injection :
En cas de transplantation simultanée avec un autre organe, les îlots sont injectés chirurgicalement dans le même temps opératoire. Lors d'une greffe combinée avec un rein par exemple, une veine colique ou mésentérique est abordée par la même incision que le rein. L'injection est effectuée dans l'une de ces veines, qui se jettent dans la veine porte.
En cas de transplantation d'îlots seuls (après une greffe d'organe solide déjà en fonction, ou en l'absence d'autre greffon), l'injection est réalisée en radiologie par ponction per-cutanée et trans-hépatique de la veine porte. Cette intervention est réalisée par un radiologue, en anesthésie locale.
Quels contrôles faut-il réaliser après une transplantation d'îlots ?
Le suivi après une greffe d'îlots est similaire à celui de toute autre greffe. Il est hebdomadaire au début, puis de plus en plus espacé. Il est le plus rapidement possible effectué en collaboration avec le médecin traitant. Des contrôles spécifiques aux îlots sont effectués à 1, 3, 6, 12 mois et ensuite toutes les années. Ils comportent des dosages du C-peptide et des tests dynamiques (test au glucagon, test oral de tolérance au glucose ou test intra-veineux de tolérance au glucose).
Les résultats les plus récents de la transplantation d'îlots de Langerhans lui donne une place à part entière dans le traitement du diabète de type I. Les espoirs et les restrictions imposés par une telle procédure doivent être connus non seulement par la communauté médicale, mais aussi par les patients eux-même. Nous pourrons ainsi en faire bénéficier les patients les plus adéquats, tout en informant de manière différenciée ceux qui n'en présentent pas l'indication.
Que faut-il retenir ?
Le suivi après une greffe d'îlots est similaire à celui de toute autre greffe. Il est hebdomadaire au début, puis de plus en plus espacé. Il est le plus rapidement possible effectué en collaboration avec le médecin traitant. Des contrôles spécifiques aux îlots sont effectués à 1, 3, 6, 12 mois et ensuite toutes les années. Ils comportent des dosages du C-peptide et des tests dynamiques (test au glucagon, test oral de tolérance au glucose ou test intra-veineux de tolérance au glucose).
Les résultats les plus récents de la transplantation d'îlots de Langerhans lui donne une place à part entière dans le traitement du diabète de type I. Les espoirs et les restrictions imposés par une telle procédure doivent être connus non seulement par la communauté médicale, mais aussi par les patients eux-même. Nous pourrons ainsi en faire bénéficier les patients les plus adéquats, tout en informant de manière différenciée ceux qui n'en présentent pas l'indication.
Pour plus d'information
Source: Vous trouverez de suite un article écrit par l'équipe d'investigations chirurgicales, de radiodiagnostic et radiologie interventionnelle, d'endocrinologie et de diabétologie des Hôpitaux Universitaires de Genève, publié sur la revue médicale Médecine et Hygiène en 2000 (Médecine &Hygiène 2000, vol.58 , no 2321, pp. 2218-2222) qui explique le fonctionnement et les indications d'une transplantation d'îlots de Langherans pour le traitement du diabète.
